on SANOFI-AVENTIS (EPA:SAN)
La FDA approuve Qfitlia pour le traitement de l'hémophilie A et B
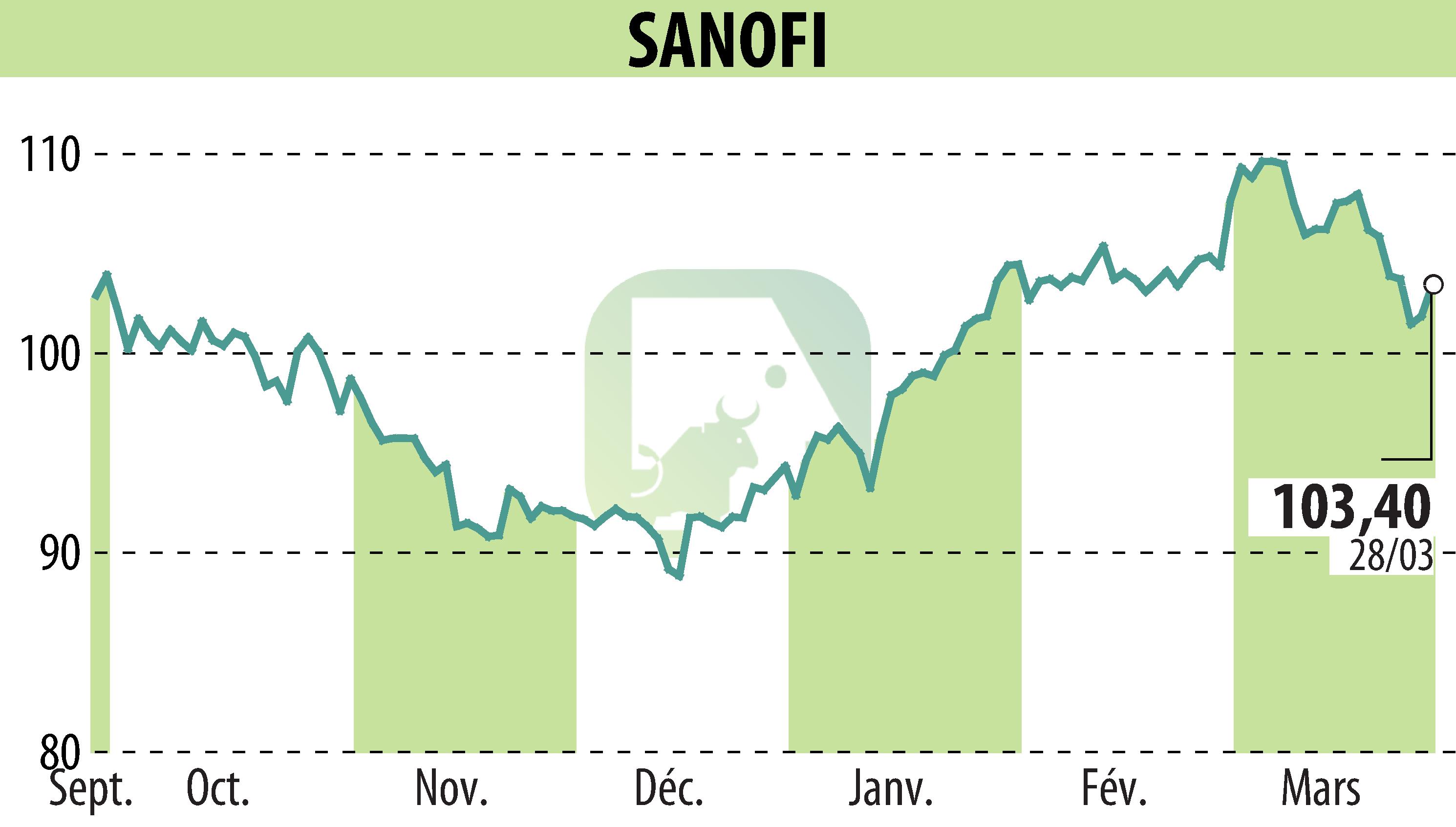
Le 28 mars 2025, la FDA a approuvé Qfitlia (fitusiran), marquant une étape importante dans le traitement de l'hémophilie aux États-Unis. Qfitlia est le premier traitement hypothrombinique conçu pour les patients atteints d'hémophilie A ou B, avec ou sans inhibiteurs. Cette approbation fait suite aux études de phase III ATLAS, qui ont mis en évidence des réductions notables des taux de saignement annualisés (TSA) parmi différents groupes de patients. Le mécanisme unique de Qfitlia consiste à réduire l'antithrombine pour augmenter la production de thrombine, améliorant ainsi la coagulation sanguine.
Qfitlia ne nécessite que six injections par an, ce qui simplifie le traitement. Les essais cliniques ont révélé une réduction significative de 71 % des PTA chez les patients sans inhibiteurs, par rapport aux traitements traditionnels. Cependant, les effets indésirables potentiels incluent des événements thrombotiques et des infections.
La FDA a également approuvé un test diagnostique complémentaire pour mesurer les taux d'AT, améliorant ainsi la précision du traitement. Qfitlia devrait proposer un prix comparable aux traitements existants, avec des services d'accompagnement des patients dans le cadre du programme HemAssist. Des décisions réglementaires au Brésil et en Chine sont attendues en 2025.
R. E.
Copyright © 2025 FinanzWire, all reproduction and representation rights reserved.
Disclaimer: although drawn from the best sources, the information and analyzes disseminated by FinanzWire are provided for informational purposes only and in no way constitute an incentive to take a position on the financial markets.
Click here to consult the press release on which this article is based
See all SANOFI-AVENTIS news
